CCC Forschungsförderung: 14 herausragende Projekte ausgezeichnet
Anfang Mai 2022 hat das Comprehensive Cancer Center (CCC) von MedUni Wien und AKH Wien 14 Forschungsgrants an innovative, translationale Krebsforschungsprojekte verliehen.
Die Mittel stammen aus den Einnahmen des Krebsforschungslaufs und aus Spenden an die Initiative Krebsforschung. Die Auswahl der Projekte erfolgte durch eine internationale Expert:innen-Jury. Diese wählte aus 60 Einreichungen die 14 Projekte aus, die am meisten durch ihren innovativen Forschungsansatz, ihre onkologische Relevanz und ihre Umsetzbarkeit überzeugten. Im Rahmen der Veranstaltung im Jugendstilhörsaal der MedUni Wien fand auch die feierliche Übergabe der CCC Best Paper Awards statt. Mit ihr wurden die sieben besten wissenschaftlichen Publikationen junger CCC-Mitglieder gewürdigt.
Die Verleihung der CCC-Forschungsförderung und die Präsentation der Projekte fand im Beisein der Spender:innen, Förder:innen und Partner der Initiative Krebsforschung statt, die damit Einblick in die Verwendung ihrer Beiträge erhielten.
Michaela Fritz, Vizerektorin für Forschung und Innovation, eröffnete die Preisverleihung und nahm anschließend gemeinsam mit Maria Sibilia, Leiterin des Zentrums für Krebsforschung und stellvertretende Leiterin des CCC, die Verleihung der Grants vor. Joachim Widder, Leiter der Universitätsklinik für Radioonkologie von MedUni Wien und AKH Wien sowie Leiter des CCC, zeichnete danach die Gewinner:innen des Best Paper Awards aus.
Die Vielfalt der Projekte spannt einen Bogen über verschiedenen Entitäten, Fachgebiete und wissenschaftliche Fragestellungen und spiegelt das breite Spektrum wider, in dem Krebsforschung an der MedUni Wien betrieben wird. Die Forschungsgruppen stammen sowohl aus der Klinik als auch aus der Grundlagenwissenschaft. Bei allen 14 Forschungsprojekten steht ein translationaler Ansatz im Vordergrund.

Trotz der zunehmenden Zahl potenzieller zielgerichteter Therapien für Darmkrebs sind die Rückfall- und Resistenzraten nach wie vor hoch. Daher sind neue Medikamente, um Resistenzen gegen Krebsmedikamente zu überwinden, erforderlich. Bernadette Blauensteiner, Zentrum für Krebsforschung der MedUni Wien und Mitglied des Comprehensive Cancer Center (CCC) Vienna von MedUni Wien und AKH Wien, erforscht im vom CCC geförderten Forschungsprojekt, wie das Oberflächenprotein Axl das Tumorwachstum beeinflusst. In der vorliegenden Studie hofft sie aufzuklären, welche Zellen im Darmkrebsgeschehen Axl exprimieren (auf der Oberfläche ausbilden), um zu prüfen, ob ein gezielter Angriff auf Axl bei dieser Erkrankung möglich ist. Bisher wurden selektive Axl-Inhibitoren noch nicht in klinischen Studien für Darmkrebs getestet, da man befürchtet, dass sie schwerwiegende Entzündungsreaktionen auslösen könnten.
Das Oberflächenprotein Axl kann mehrere wichtige Signalwege wie Proliferation (Zellteilung), Überleben und Migration (Abwanderung) regulieren. Darüber hinaus wurde in früheren Studien beobachtet, dass Axl Immunsuppression (Unterdrückung des Immunsystems) und Therapieresistenz hervorruft. Bislang gibt es jedoch noch keine aktive klinische Studie zur gezielten Hemmung von Axl bei Darmkrebs. Erste Experimente zur pharmakologischen und genetischen Axl-Inhibition zeigen jedoch vielversprechende Ergebnisse: Die Hemmung von Axl scheint die Resistenz gegen Chemo- und zielgerichtete Therapien bei Darmkrebs zu umgehen.
Andere Forschungsgruppen machen jedoch darauf aufmerksam, dass Axl bei Darmkrebs eine wichtige Rolle bei der negativen Regulierung von Entzündungen spielt. Chronische Darmentzündungen (Kolitis) stehen in engem Zusammenhang mit der Entwicklung von Darmkrebs. Daher ist es wichtig, zu klären, welche Zellen Axl ausbilden und welche Folgen eine Axl-Hemmung im Darmkrebs-Stroma, dem Bindegewebe in das die Krebszellen eingebettet sind, hat. Bislang ist der genaue Antitumor-Mechanismus von Axl-Inhibitoren bei Darmkrebs unbekannt.
Blauensteiner und ihr Team stellen die Hypothese auf, dass Axl einen Einfluss auf die Polarisierung von Stroma- und Immunzellen hat und nicht auf deren Rekrutierung. Die Zellpolarität spielt eine wichtige Rolle in verschiedenen zellulären Prozessen, wie zum Beispiel der Antitumor-Immunität. Bedingt durch das Tumorgeschehen können sie ihre Polarität und damit Teile der Funktion verändern. Angesichts der zunehmenden Belege dafür, dass Stroma- und Immunzellen an der Tumorentstehung beteiligt sind, werden neue Strategien benötigt, die auf eine Repolarisierung oder Zerstörung des TME abzielen. Im Rahmen des Forschungsprojekts werden sowohl menschliches Material als auch bereits etablierte genetische Mausmodelle von Darmkrebs verwendet. Mit ihrer Hilfe wird die Situation beim Menschen simuliert, um den Mechanismus der Axl-Inhibitor-Antwort klären zu können.
Zusammenspiel der unterschiedlichen Zellen in einem Tumor
Für diese Analyse sequenziert die Forscherin Zellpopulationen aus Primärtumorgewebe. Axl-positive, vom Darmkrebs stammende Immunzellen und stromale Zellen werden mittels Sequenzierung auf ihre Polarisierung untersucht. Die Wirkung einer Axl-Hemmung auf die (Re-)Polarisierung auf Axl-positive Zellen wird ebenfalls durch Sequenzierung untersucht.
Weiters soll die klinische Auswirkung der Axl-Expression in verschiedenen Zelltypen analysiert werden.
Es werden sogenannte funktionelle Assays mit isolierten Immun- und Stromazellen durchgeführt, also Tests, die die Funktion der jeweiligen Zellen beurteilen. Damit werden das Zusammenspiel mit bösartigen Zellen untersucht und die Bedingungen in der Tumor Mikroumgebung nachgeahmt. Die Auswirkung der stromalen Axl-Hemmung auf das Tumorwachstum und die Tumorprogression wird auch in Mausmodellen untersucht werden. Im Einzelnen möchte Blauensteiner den Phänotyp der Axl-exprimierenden tumorassoziierten Zellpopulationen untersuchen, um die Durchführbarkeit einer Axl-Behandlung bei Darmkrebs zu beurteilen.
Die Ergebnisse der Experimente können neue Erkenntnisse darüber liefern, wie Axl-Inhibitoren beim Darmkrebs wirken und inwieweit eine Axl-Inhibition die in den Tumor eingewanderten Immunzellen, den Tumor insgesamt und damit auch das Therapieansprechen beeinflusst. Da Axl auch bei anderen Tumorarten, z. B. Glioblastom, Brust- und Leberkrebs, eine Rolle spielt, könnten diese Ergebnisse neue Wege für die Behandlung von Patienten mit anderen Tumorarten eröffnen.
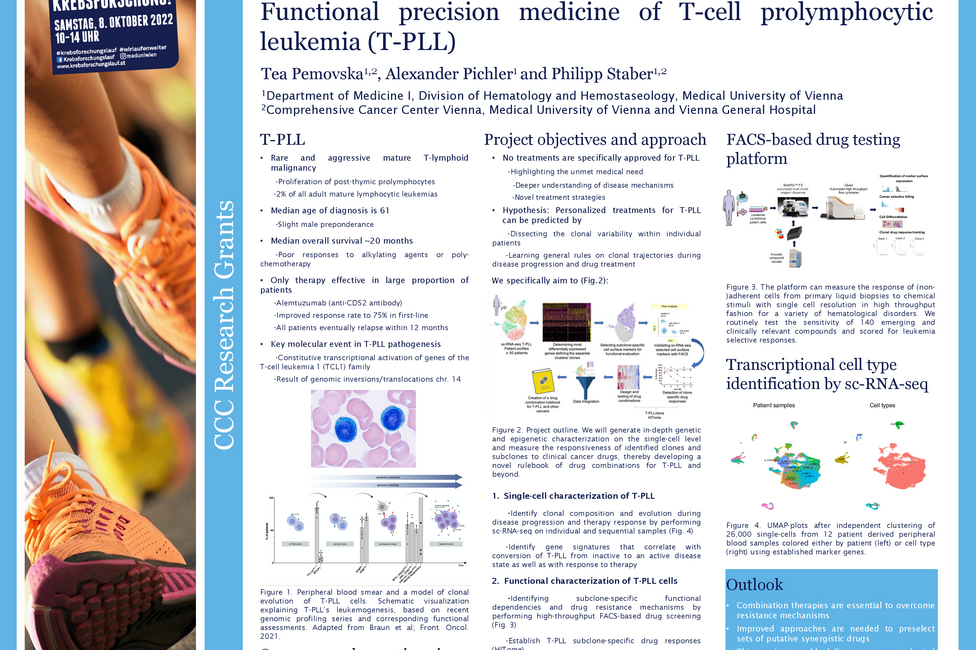
Zielgerichtete Therapien zeigen in der Bekämpfung des malignen Melanoms, also des schwarzen Hautkrebses, große Wirkung. Leider führen vor allem Kinase-Inhibitoren, das sind Arzneistoffe, die das Tumorwachstum hemmen, häufig zu schweren Nebenwirkungen, hervorgerufen durch Schädigungen der Gefäße. Sophie Bromberger untersucht in ihrem Forschungsprojekt, das durch die CCC-Forschungsförderung unterstützt wird, welche zellulären Mechanismen diese unerwünschten Folgeerscheinungen auslösen. Ziel ist es, Erkenntnisse darüber zu gewinnen, wie man Nebenwirkungen eindämmen und Medikamente exakter dosieren kann, damit sie besser verträglich sind. Das könnte dazu führen, dass PatientInnen neue und verbesserte Therapieoptionen zur Verfügung stehen.
In Österreich erkranken rund 1.745 Personen pro Jahr an einem malignen Melanom. Damit ist der schwarze Hautkrebs für rund 4 Prozent aller Krebserkrankungen verantwortlich.
Durch die Einführung von zielgerichteten Therapien aber auch von Immuntherapien kann das maligne Melanom heute viel besser behandelt werden als noch vor 10 Jahren. Dennoch werden beide Therapiekonzepte noch intensiv beforscht, denn während Immuntherapien nur bei einer kleinen Anzahl von PatientInnen wirken, verursachen zielgerichtete Therapien häufig so schwere Nebenwirkungen, dass die Therapie abgebrochen oder unterbrochen werden muss.
Barrierefunktion der Gefäße
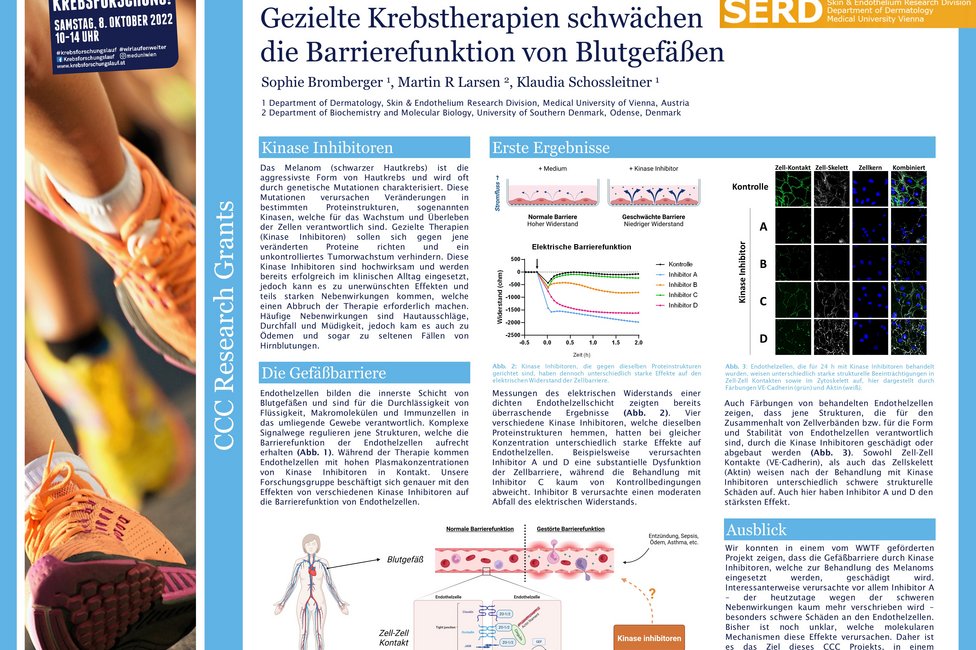
Zielgerichtete Therapien richten sich meist gegen bestimmte Proteinstrukturen, sogenannte Kinasen, die auf oder in unseren Zellen vorhanden sind und dort bestimmte Funktionen, wie zum Beispiel die Aktivierung von Botenstoffen oder Signalwegen, erfüllen. Veränderungen an diesen Proteinen können zur Fehlsteuerung von zellulären Prozessen führen und damit Krebserkrankungen befördern. Obwohl zielgerichtete Kinase-Inhibitoren gegen veränderte Proteinvarianten in Tumoren entwickelt werden, haben diese häufig auch unspezifische Effekte in gesunden Zellen. Die beim malignen Melanom eingesetzten Kinase-inhibitoren können beispielsweise eine Reduktion der Barrierefunktion von Gefäßwänden bewirken, was von schwerem Juckreiz über einen Hautausschlag bis zu inneren Blutungen führen kann.
Sophie Bromberger, Grundlagenforscherin an der Universitätsklinik für Dermatologie von MedUni Wien und AKH Wien sowie Mitglied des Comprehensive Cancer Center (CCC) Vienna, untersucht in ihrem Projekt die Therapie-bedingten Veränderungen an bestimmten, sogenannten phosphorylierten Proteinen in den Zellen der Blutgefäße und wie diese die Barrierefunktion der Gefäße beeinflussen.
Bromberger: „Die Erkenntnisse dieses translationalen Projekts könnten Informationen für die Entwicklung von nebenwirkungsärmeren Therapien liefern und dabei unterstützen, bereits zugelassene Medikamente besser zu dosieren. Insgesamt könnte sich dadurch das Spektrum an gut verträglichen und wirksamen Therapien für das maligne Melanom erweitern.“

Beim Dickdarmkrebs im metastasierten Stadium kommt es häufig zum Therapieversagen beziehungsweise zur Bildung von Therapieresistenzen. Helmut Dolznig, Molekularbiologe am Institut für Medizinische Genetik und Mitglied des Comprehensive Cancer Center von MedUni Wien und AKH Wien, forscht am Anteil, den Bindegewebszellen am Tumorgeschehen und an der Bildung von Chemotherapie-Resistenzen haben. In seinem sehr interdisziplinär aufgesetzten Projekt, das durch die CCC-Forschungsförderung unterstützt wird, entwickelt er neuartige Organoid-Zellkulturmodelle, die neben Tumorepithelzellen auch Bindegewebszellen enthalten.
Damit möchte er neue präklinische Modelle zur Testung von Chemotherapien und in späterer Folge auch anderer Substanzklassen entwickeln und der Resistenzbildung auf die Spur kommen.
Menschen mit Dickdarmkrebs entwickeln häufig Metastasen in der Leber, weil die Erkrankung oft sehr spät erkannt wird. Nur ein Drittel der PatientInnen mit Lebermetastasen kann geheilt werden. Wie gut die Aussichten der Betroffenen sind, hängt stark davon ab, wie gut die Töchtergeschwüre in der Leber reseziert (also chirurgisch entfernt) werden konnten, weil sehr viele PatientInnen Resistenzen gegen die heute standardmäßig eingesetzte Chemotherapie entwickeln.
Der Tumor und seine Nachbarzellen
Wie es zu diesen Resistenzen kommt, ist ein Feld, das derzeit stark beforscht wird. Stand früher vor allem die Tumorzelle im Fokus des wissenschaftlichen Interesses, so beschäftigen sich ForscherInnen heute zunehmend mit der sogenannten Mikroumgebung von Tumoren, also mit den Zellen in ihrer Umgebung.
Helmut Dolznig möchte nun analysieren, welche Rolle das Bindegewebe und hier vor allem Fibroblasten im Tumorgeschehen haben. Dafür erstellt er in vitro, also in einem Laborgefäß, neuartige organotypische Kulturen her, die menschliche Zellen aus den operativ entfernten Krebsgeschwüren enthalten. Das sind dreidimensionale Modelle, die normalerweise aus Epithelzellen, also den Schleimhautzellen des Darms, bestehen, die durch Mutationen krebsartig verändert sind. Dolznig und seinem Team ist es nun gelungen, auch Bindegewebszellen in dieses Tumormodell zu integrieren. Auf diese Weise können die ForscherInnen aus Zellen individueller PatientInnen deren Tumor sehr real nachbauen und in der Petrischale prüfen, wie die Zellen mit einander kommunizieren und wie sie sich gegenseitig beeinflussen.
Dolznig: „Damit erzeugen wir ein komplett humanes Modell, das die Realität des Tumors in einer Person sehr gut abbildet. Wir können so testen, wie dieser Tumor zum Beispiel auf bestimmte Therapien reagiert und auch mehrere zugelassene Substanzen gleichzeitig testen, was in PatientInnen nicht möglich und zumutbar wäre. Und man kann experimentelle Krebsmedikamente testen, die sehr früh in der Entwicklung stehen oder klinisch noch nicht zugelassen wurden“
Mutidisziplinäre Forschung.
Dolznig: „Das Forschungsprojekt ist sehr stark interdisziplinär ausgerichtet. Neben den ChirurgInnen, die das Tumorgewebe gewinnen, sind OnkologInnen, PathologInnen, SpezialistInnen für Zellkulturen und für Signalwege involviert. Ein Unterfangen wie die Schaffung eines derart komplexen Zellkulturmodells und die geplanten hochspezialisierten Untersuchungen können nur an einem multidisziplinär aufgestellten Zentrum durchgeführt werden.“
Die Beteiligung von ExpertInnen für Signalwege ist wichtig, weil in einem zweiten Teil des Projekts untersucht wird, ob Stammzellen einen Anteil an der Entwicklung von bestimmten Therapieresistenzen haben und welche Rolle hier die Interaktion mit dem Protein STAT5 und dem zugehörigen STAT5-Signalweg spielt.
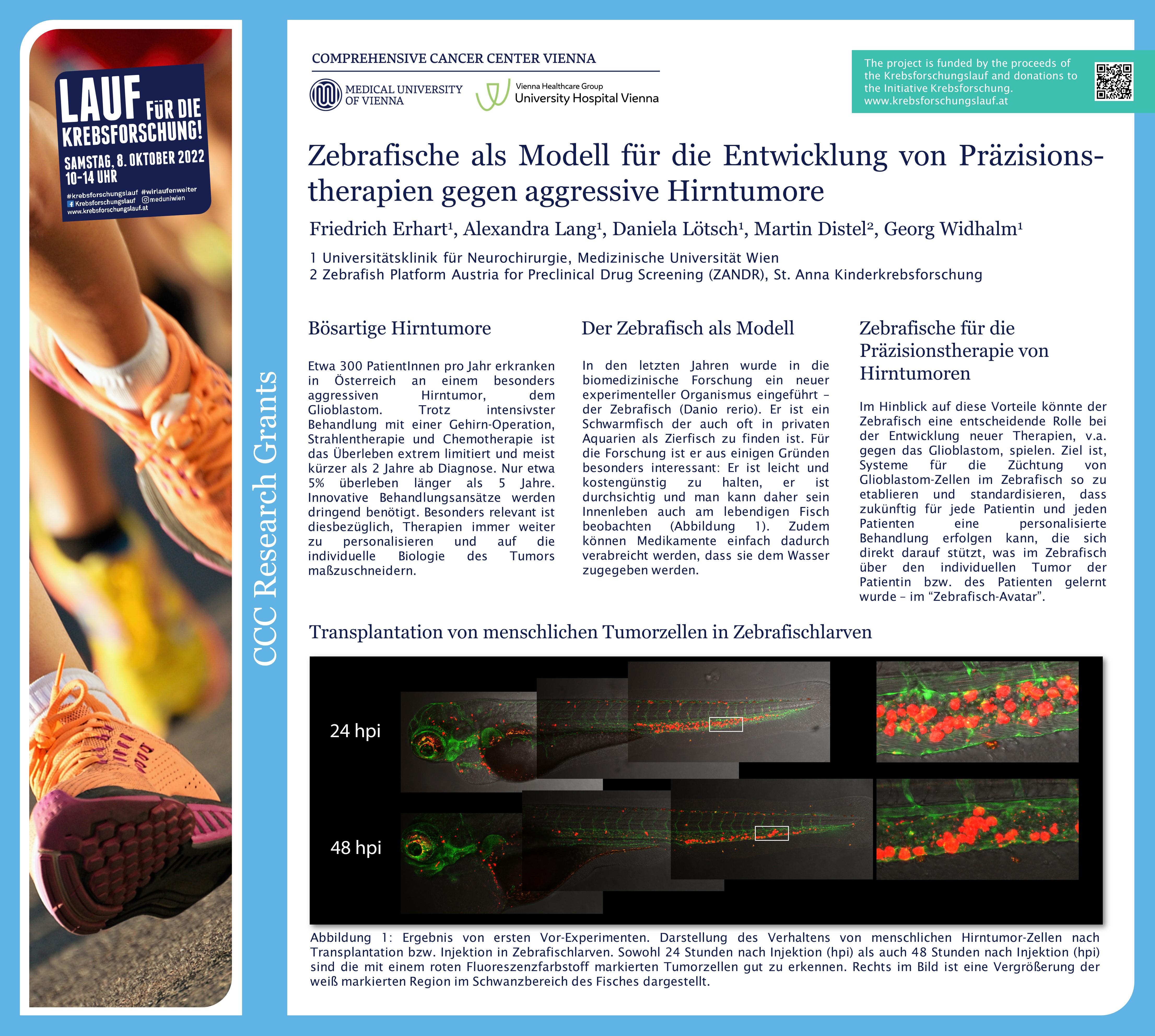
Glioblastome sind sehr aggressive Hirntumoren, für die es nur begrenzte Behandlungsmöglichkeiten gibt. Friedrich Erhart, Universitätsklinik für Neurochirurgie und Mitglied des Comprehensive Cancer Center von MedUni Wien und AKH Wien, sucht daher nach personalisierten Therapien, die auf die spezifische Tumorbiologie einzelner PatientInnen zugeschnitten sind. Dafür prüft er, ob der Zebrafisch ein alternatives Tiermodell wäre, in dem die Wirkung von Krebsmedikamenten einfach, rasch und kostengünstig geprüft werden könnte.
Glioblastome zählen zu den häufigsten und aggressivsten Hirntumoren. Pro Jahr werden in Österreich rund 300 PatientInnen mit dieser Erkrankung diagnostiziert. Die Standardtherapie ist die chirurgische Entfernung des Tumors gefolgt von einer Radio-Chemotherapie, wobei die Lebenserwartung beschränkt bleibt: Die meisten der Betroffenen leben nach der Diagnose nicht länger als 20 Monate. Auch die Immuntherapie war bis dato bei der Therapie von Krebserkrankungen des Gehirns nicht erfolgreich. In seinem, mit der CCC-Forschungsförderung ausgezeichneten Projekt, prüft Erhart, ob es möglich ist, Zebrafische als Avatare für PatientInnen zu nutzen, an denen die Wirkung unterschiedlicher, tumorbekämpfender Substanzen ausgetestet werden.
Zellbiologisches in vivo Modell
Zebrafische gelten als aussichtsreiche Kandidaten für die Etablierung eines derartigen Modells, weil sie leicht zu züchten und zu halten sind. Zebrafischlarven, die für die Versuche eingesetzt werden, sind durchsichtig, das heißt, dass menschliche Krebszellen, die man ihnen injiziert, im Mikroskop gut zu sehen sind, ohne dass man sie aufschneiden oder gar töten muss. Darüber hinaus, können Substanzen, die man ins Wasser gibt, gut von ihnen aufgenommen werden. Medikamententests lassen sich somit leicht und kostengünstig durchführen.
Ein ähnliches Zebrafischmodell wurde erst kürzlich für das Kolorektalkarzinom etabliert und erste Ergebnisse zeigen, dass diese Modelle Aussagekraft für das Therapieansprechen beim Menschen haben könnten.
Ehrgeizige Ziele
Das Projekt verfolgt kurzfristig das Ziel, eine valide Forschungsplattform zu etablieren. Das heißt, dass alle Abläufe des Projekts so standardisiert werden, dass die Untersuchungsergebnisse für wissenschaftliche Studien herangezogen werden können. Das gilt für alle Prozesse von der Etablierung der Labordetails, das Aufsetzen der Standards für die Entnahme der Tumorzellen bis zu den eigentlichen Untersuchungen.
Das mittelfristige Ziel ist es, sogenannte „co-clincal trials“ durchzuführen. Dabei werden menschliche Tumorzellen in die Fische injiziert und dem Wasser danach antitumorale Substanzen zugesetzt, die in die Fischlarven diffundieren. Aus der Beobachtung, welche Folgen dies für die Tumorzellen in den Fischen hat, plant Erhart die Wirkung von Substanzen oder Substanzkombinationen abzuleiten.
Erhart: „Wir versuchen hier ein Modell zu etablieren, das ein Zwischenstadium zwischen der Zelllinie in der Petrischale und einem Modell im Säugetier darstellt. Langfristig könnten damit bessere und rasche Therapiefindungen kostengünstig realisiert werden. Wir verwenden Krebszellen individueller PatientInnen und testen ihre Reaktion auf die Substanzen. Wenn wir tatsächlich davon Therapien ableiten und einsetzen können, kann man von personalisierter Behandlung im Wortsinn sprechen.“
Das Projekt ist ein Kooperationsprojekt mit dem Team von Martin Distel der „Zebrafish platform Austria for preclinical drug screening (ZANDR)“ an der St. Anna Kinderkrebsforschung. Von der MedUni Wien stammt die Expertise auf dem Gebiet der neuroonkologischen Fragestellungen, unterstützt vor allem durch Georg Widhalm, dem Leiter des CCC Tumorboards Neuroonkologie.

Tumoren haben unterschiedliche Strategien entwickelt, wie sie das Immunsystem austricksen können. Eine Methode ist, Immunzellen so zu beeinflussen, dass sie ihre Fähigkeiten in den Dienst der Krebszelle stellen. So können Tumorzellen beispielsweise Makrophagen, die Fresszellen des Immunsystems, so verändern, dass sie die Tumorzellen nicht mehr fressen und darüber hinaus auch noch Killer-T-Zellen, die die Tumorzellen töten würden, inaktivieren. Matthias Farlik-Födinger, Molekularbiologe an der Universitätsklinik für Dermatologie und Mitglied des Comprehensive Cancer Center (CCC) von MedUni Wien und AKH Wien, prüft in seinem Projekt, wie die Zellen in der Tumor-Mikroumgebung miteinander kommunizieren, also welche Signale und Signalwege involviert sind, sowie welche Zelltypen mit welchen anderen interagieren und möglicherweise Dritte beeinflussen. Die Ergebnisse könnten die Basis für neue Therapieansätze liefern.
Mit 4.900 Neuerkrankungen pro Jahr ist Darmkrebs die dritthäufigste Krebserkrankung in Österreich. Viele Fälle werden erst entdeckt, wenn die Erkrankung bereits die Lymphknoten oder andere Organe befallen hat. Von den 25 Prozent der PatientInnen, die bereits mit einer metastasierten Darmkrebserkrankung diagnostiziert werden, überleben nur etwa 14 Prozent die ersten 5 Jahre trotz Therapie. Da die Therapieoptionen in diesem Stadium begrenzt sind, sind ForscherInnen weltweit auf der Suche nach neuen Strategien.
Matthias Farlik-Födinger beschäftigt sich intensiv mit einer speziellen Untergruppe des Dickdarmkrebses, dem sogenannten mikrosatellitenstabilen (MSS) Kolonkarzinom, das sich dadurch auszeichnet, dass nur wenige Gene mutiert sind. Sein Interesse gilt der Mikroumgebung des Tumors und somit den Zellen, die dort interagieren.
Vom Angreifer zum Diener
Tumorzellen sind in der Lage Makrophagen so umzupolen, dass sie ihre Funktion stoppen und darüber hinaus unterschiedliche Checkpoint-Moleküle ausbilden, also Rezeptoren, die an Killer-T-Zellen binden und diese damit inaktivieren.
Ein Therapieansatz ist, diese Checkpoints zu inhibieren, also zu hemmen, und somit die Killer-Zellen wieder zu aktivieren. Im ersten Teil des durch die CCC Forschungsförderung unterstützten Projekts ermittelt Farlik-Födinger nun, welche Checkpoints von Makrophagen ausgebildet werden und wie sie blockiert werden könnten.
Soziale Netzwerke der Zellen
Im zweiten Teil des Projektes vergleicht er die Zellen von Metastasen mit Zellen des Primums, also des Ausgangstumors, um festzustellen, ob und welche Gemeinsamkeiten es auf zellulärer Ebene gibt und ob sich daraus Mechanismen ableiten lassen, die für die Tumorentwicklung entscheidend sein könnten.
Außerdem untersucht er in einem selbst entwickelten Verfahren, wie Tumorzellen, Makrophagen und Killer T-Zellen (CD8+ T-Zellen) miteinander kommunizieren und wie sie sich beeinflussen. Farlik-Födinger: „Zellen im Tumorgeschehen entwickeln so etwas wie ein ‚soziales Netzwerk‘, in dem sie sich gegenseitig beeinflussen. Wir untersuchen hier, wie dieses Netzwerk aufgebaut ist und wie wir es stören könnten.“
Partnervermittlung für Zellen
Dafür hat er ein Gerät, das zur Anreicherung von im Blut zirkulierenden Tumorzellen konzipiert wurde, umfunktioniert, so dass es für Zell-Zell-Interaktionsstudien genutzt werden kann. Farlik-Födinger: „Man muss sich das ein bisschen wie in der Partnervermittlungs-Show ‚Herzblatt‘ vorstellen: Wir geben zwei oder mehrere Zelltypen in das Gerät, lassen einzelne Zellen kontrolliert und in bestimmter Reihenfolge miteinander interagieren und prüfen nach einiger Zeit, wie die Interaktion gelaufen ist und ob sie funktionelle Auswirkungen hatte.“
Was den Forscher besonders interessiert, ist, ob zum Beispiel ein im Tumor sozialisierter Makrophage eine T-Zelle, die nicht aus dem Tumorkontext kommt, ebenfalls beeinflussen kann, denn das würde einen Hinweis auf eine mögliche Therapiestrategie geben. Der Hintergrund für diesen Forschungsansatz sind zwei unterschiedliche Behandlungsansätze: Entweder man führt dem Tumor frische T-Zellen zu, die ihn bekämpfen. Das hat aber nur Sinn, wenn die T-Zellen nicht sofort von den tumor-assoziierten Makrophagen inaktiviert werden. Oder man richtet sich von Beginn an gegen die Makrophagen und re-programmiert oder tötet sie, damit sie die T-Zellen nicht inaktivieren können.

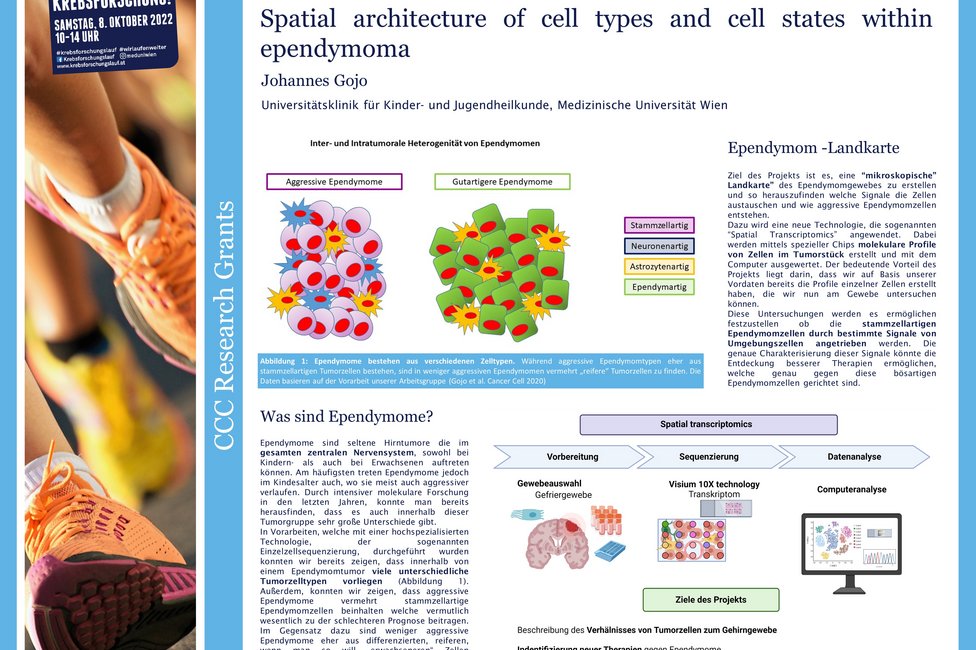
Ependymome sind spezielle, häufig aggressive Hirntumoren. Seit fast einem Jahrzent forschen Johannes Gojo, Universitätsklinik für Kinder- und Jugendheilkunde von MedUni Wien und AKH Wien sowie Leiter des Young CCC, und sein Team an dieser Erkrankung und konnten klären, warum manche dieser Tumoren besonders aggressiv und schlecht zu behandeln sind. Im vom Comprehensive Cancer Center mit einen Forschungsgrant geförderten Projekt, gehen sie einen Schritt weiter und untersuchen, wo in der Tumorstruktur die speziell bösartigen Zellen zu finden sind und wie sie mit ihrem Umfeld, dem sogenannten Tumor Microenvironment interagieren. Damit könnten neue Behandlungsansätze gewonnen werden.
Ependymome sind seltene Hirntumoren, die bei Kindern und bei Erwachsenen auftreten können. Es handelt sich um eine heterogene Tumorgruppe, die vorwiegend durch eine Operation des Tumors und Strahlentherapie behandelt wird, da Chemotherapien nur eine beschränkte Wirkung zeigen und zielgerichtete Therapien noch nicht etabliert wurden. Bei einem Drittel der PatientInnen ist eine vollständige chirurgische Entfernung des Tumors ohne neurologische Folgeschäden nicht möglich, weshalb neuartige Therapieansätze dringend benötigt werden.
Vorangegangene Arbeiten haben gezeigt, dass das bösartige Wachstum der Ependymome vor allem durch eine fehlerhafte Regulierung der Gene angetrieben wird.
Gojo: „Wir untersuchen nun das Vorkommen und die Verteilung der unterschiedlichen Tumorzelltypen. Durch die Analyse und in Folge die Charakterisierung dieser molekularen Landkarte hoffen wir herauszufinden, welche genetischen Veränderungen oder Signalwege dafür verantwortlich sind, dass die Tumorzellen aggressiv wachsen und warum es zu Therapieresistenzen kommt.“
Neue Methode zur Profilerstellung
Die ForscherInnen verwenden für ihre Analysen eine neuartige molekulare Profilierungsmethode, genannt „Spatial transcriptomics“, die ihnen erlaubt, die Genaktivität der Tumorzellen zu messen und auch festzuhalten, wo in der Tumorstruktur diese Aktivität auftritt. Damit hoffen sie zu klären, welche Zelltypen im Tumor benachbart sind und ob und wie sie sich beeinflussen.
Gojo: „Wir arbeiten seit sechs Jahren intensiv an diesem speziellen Thema. In unseren Einzelzellanalysen der vorangegangenen Arbeit konnten wir zeigen, welche Zellen involviert sind. Jetzt kartieren wir sie, um möglichen Therapieansätzen auf die Spur zu kommen. Wissenschaft passiert in kleinen Schritten, aufbauend auf den vorhergegangenen Erkenntnissen. Deshalb freuen wir uns sehr über den Grant, der die Fortführung dieses Prozesses ermöglicht.“
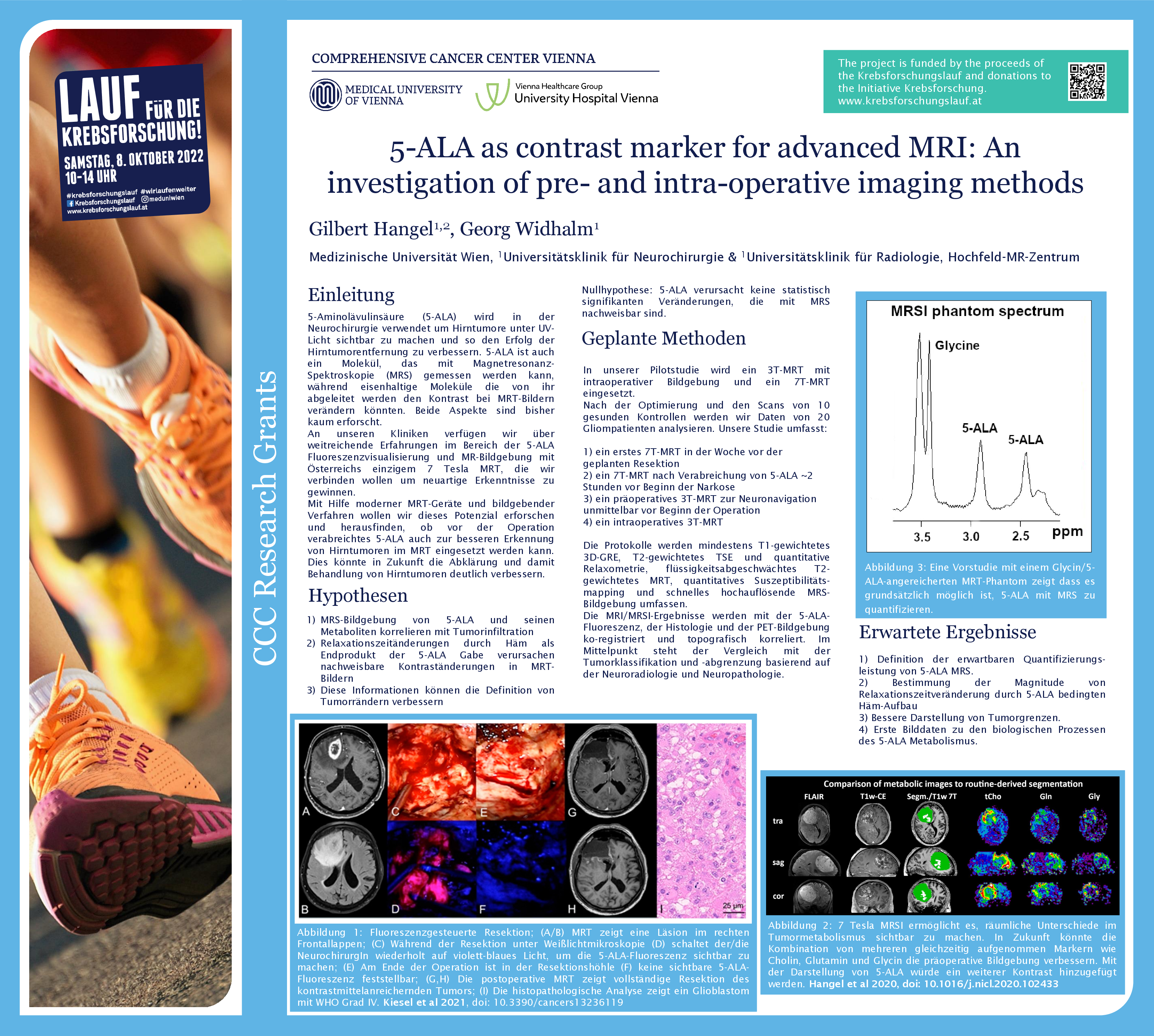
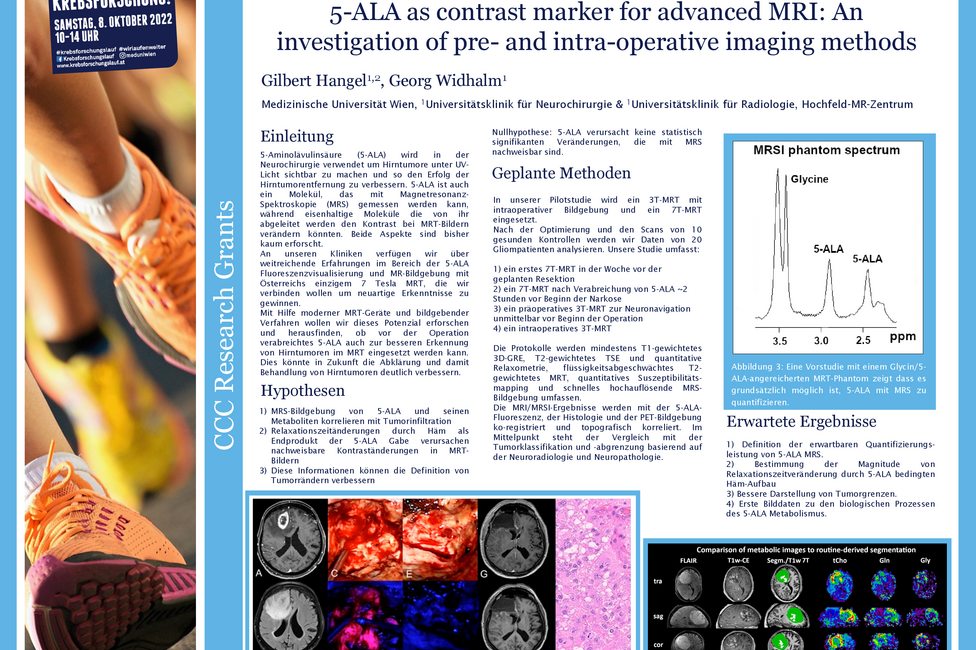
Gliome sind Hirntumoren, die chirurgisch entfernt werden müssen. Um den Tumor besser von gesundem Gewebe unterscheiden zu können, nehmen PatientInnen vor der OP den Fluoreszenzmarker 5-ALA ein, der sich im Tumorgewebe anreichert. Wird das Gewebe während der OP mit UV-Licht bestrahlt, beginnen die Tumorzellen rot zu leuchten und können so gut identifiziert und entfernt werden. Gilbert Hangel, Physiker an der Universitätsklinik für Neurochirurgie von MedUni Wien und AKH Wien, und sein Team untersuchen nun mittels 7-Tesla Magnetresonanztomographie (MRT) einerseits, ob 5-ALA mit speziellen Techniken direkt im MRT im Tumor abgebildet werden kann. Zusätzlich prüft er, ob 5-ALA einen Einfluss auf die routinemäßige Darstellung der Tumoren im MRT hat, ob sie also beispielweise besser oder schlechter sichtbar werden.
In Österreich erkranken rund 450 Personen pro Jahr an einem Gliom. Diese Tumoren weisen eine schlechte Prognose auf. Hauptsäule der Therapie ist eine möglichst umfangreiche und sichere neurochirurgische Entfernung, die in den vergangenen Jahren entscheidend durch den Einsatz von 5-ALA verbessert werden konnte.
Bildgebung vor und während der Operation
Das Team rund um Hangel verfolgt im vom Comprehensive Cancer Center (CCC) geförderten Krebsforschungsprojekt zwei wissenschaftliche Fragestellungen. In der ersten wird mittels 7 Tesla MRT geprüft, ob der Einsatz von 5-ALA in der MRT-Untersuchung vor der Operation zu Änderungen bei der Darstellung des Tumors führt. Im besten Fall könnte der Tumor noch besser abgegrenzt werden, was eine wichtige Hilfestellung bei der OP-Planung und Kontrolle nach der OP sein könnte. Das wäre wichtig, da verbleibende Tumorzellen oft zum Nachwachsen des Tumors führen können.
Die zweite Forschungsfrage beleuchtet, ob man mit Hilfe einer MRT-Untersuchung noch vor der Operation die Tumorinfiltration im umgebenden Gewebe messen könnte, um zu prüfen, wo Tumorzellen, vorhanden sind.
Interdisziplinäre Forschung
Das gesamte interdisziplinäre Projekt wird in enger Zusammenarbeit mit den neurochirurgischen ExpertInnen der Klinik, allen voran Georg Widhalm, einem ausgewiesenen 5-ALA Experten, durchgeführt. Die Studie ist nur möglich, weil es an der MedUni Wien und am AKH Wien neben 3 Tesla Magnetresonanztomographen, die in der klinischen Routine bereits für die Bildgebung während der OP eingesetzt werden, auch ein 7 Tesla MR-Gerät gibt. Dieses liefert noch genauere Bilder und erlaubt interoperative Bildgebung auf höchstem Niveau.
Hangel dazu: „Auf der Basis der Bilder, die das 7 Tesla MRT liefert, können neue wissenschaftliche Aussagen getroffen werden. Mit dieser interdisziplinären, translationalen Studie formen wir eine Brücke zwischen MRT-Systemen, die das Nervensystem abbilden können, und der Neurochirurgie mit dem Ziel, die Therapie von Gehirntumoren weiterzuentwickeln und zu verbessern.“

Der derzeit häufig genutzte nonavalente Impfstoff gegen Infektionen mit Humanen Papillomaviren (HPV) schützt gegen neun Hochrisikovirentypen und gegen zwei Niedrigrisikotypen, und damit vor der Entstehung von etwa 90 Prozent der Gebärmutterhalskarzinome (Zervixkarzinome) und deren Vorstufen sowie gegen Genitalwarzen (Kondylome). Ein neuartiger experimenteller HPV-Impfstoff, der gegen alle 13 Hochrisiko- und eine Vielzahl an Mittel- und Niedrigrisikotypen schützen soll, wird demnächst in einer ersten klinischen Studie geprüft. Beide Impfstoffe müssen gekühlt gelagert werden, dürfen aber keinesfalls tiefgefroren werden. Außerdem sind zwei bis drei Teilimpfungen zum Erreichen des optimalen Schutzes nötig. Beides macht die Impfstoffe teuer. Bettina Huber untersucht nun, wie man den Impfstoff hitzestabil machen und auf nanomolekularer Ebene so strukturieren kann, dass er eine Depotwirkung entfaltet. So könnte ein Stich ausreichend sein, was die Transport- und Lagerungslogistik vereinfachen und die Kosten reduzieren könnte. Vor allem in Entwicklungsländern, die die Hauptlast der Zervixkarzinome weltweit tragen, wäre dies ein entscheidender Fortschritt für erfolgreiche Impfkampagnen.
Fünf Krebsarten können durch HPV hervorgerufen werden: Der Gebärmutterhalskrebs (Zervixkarzinom), das Vulva-, das Vaginal-, das Anal- und das Rachenkarzinom. Das Virus ist sexuell übertragbar und betrifft daher Männer wie Frauen gleichermaßen. Gerade bei Männern ist die Neuerkrankungsrate beim Rachenkarzinom signifikant gestiegen, wogegen die Anzahl der Frauen, die in Österreich an Gebärmutterhalskrebs erkranken, mit rund 400 Fällen pro Jahr relativ stabil ist.
Aus den genannten logistischen Gründen, ist das Arzneimittel in vielen Ländern kaum verfügbar. Das mit der CCC-Forschungsförderung unterstützte Projekt von Bettina Huber, Immunologin an der Universitätsklinik für Dermatologie und Mitglied des Comprehensive Cancer Center (CCC) Vienna, zielt darauf ab, den Impfstoff besser lagerungsfähig zu machen und eine Dosisreduktion zu erreichen.
Gefriertrocknen statt kühlen
Dem Impfstoff wird das seit viele Jahrzehnten in Impfstoffen verwendete Aluminium-Hydroxid (Alum) zugesetzt, welches die Immunabwehr des Körpers verstärkt. Damit Alum seine Wirkung behält darf es nicht tiefgefroren werden. Dieser Umstand führt gerade in Entwicklungsländern häufig dazu, dass der Impfstoff nicht eingesetzt werden kann.
Huber untersucht nun, ob die Kombination des experimentellen HPV Impfstoffs und Alum seine Immunogenität, also die Immunabwehr induzierende Wirksamkeit, behält, wenn der gesamte Impfstoff mit einem neuen Verfahren gefriergetrocknet wird. Weiters prüft sie seine Thermostabilität, also bei welchen Temperaturen die Wirksamkeit des gefriergetrockneten Präparats gegeben ist.
Dosisreduktion
Derzeit wird der Impfstoff abhängig vom Alter der geimpften Person in zwei bis drei Dosen verabreicht. Huber und ihr Team untersuchen nun, ob man die nanomolekulare Struktur des getrockneten Präparats verändern kann, um eine Depotwirkung zu erzielen, denn eine Reduktion der nötigen Dosen würde auch die Kosten für die Immunisierung senken.
Mittels Atomic Layer Deposition (ALD; zu Deutsch Atomlagenabscheidung), einem Verfahren aus der Materialchemie, kann man extrem dünne Schichten eines Materials auf ein Ausgangsmaterial aufbringen. Im vorliegenden Fall würden die Partikel des gefriergetrockneten Impfstoffs mit vielen Schichten von Aluminium umhüllt und als letzte Schicht wieder der Impfstoff aufgebracht werden. Huber: „Die Idee dahinter ist, dass sich der Impfstoff und danach das Aluminium Schicht für Schicht im Körper auflösen. Der Impfstoff im Kern wird dadurch erst in einem gewissen zeitlichen Abstand zur eigentlichen Impfung für das Immunsystem sichtbar, was wie eine Boosterimpfung wirkt, aber eben ohne zweiten Stich.“
Ziel der Untersuchung ist herauszufinden, ob ALD auf den Impfstoff anwendbar ist, wie viele Schichten Aluminium optimal für die Wirkung wären und ob die nötige Thermostabilität erreicht werden kann.

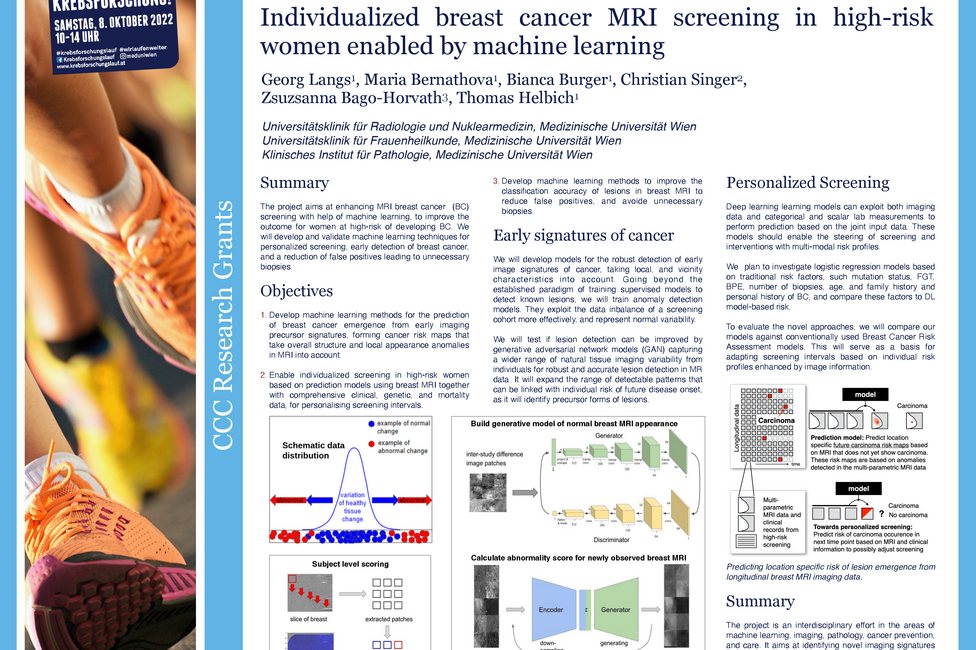
Die Magnetresonanztomographie hat sich als sensitivste Methode für das Brustkrebsscreening bei Hochrisikopatientinnen etabliert. Eine verbleibende Anzahl falsch positiver Befunde, aber auch die eingeschränkte Verfügbarkeit von MRT-Einheiten oder die Abhängigkeit von der Expertise der befundenen ÄrztInnen machen deutlich, dass es bei der Befundung der Bilder noch Raum für Verbesserungen gibt. Georg Langs, Universitätsklinik für Radiologie und Nuklearmedizin von MedUni Wien und AKH Wien sowie Mitglied des Comprehensive Cancer Center (CCC) der beiden Einrichtungen, beschäftigt sich im vom CCC geförderten Projekt damit, wie maschinelles Lernen zur Lösung dieser Herausforderungen beitragen kann. Dafür entwickeln sein Team und er Algorithmen, die künftig für die individuelle Risikoabschätzung von Hochrisikopatientinnen aber auch zur Vermeidung unnötiger Biopsien herangezogen werden könnten.
15 bis 20 Prozent der Brustkrebsfälle haben genetische Ursachen. Frauen, bei denen gewisse Mutationen nachgewiesen werden, haben ein 20-fach erhöhtes Risiko im Laufe ihres Lebens Brustkrebs zu entwickeln. Das Ziel der ForscherInnen um Langs ist es, Computerprogramme so zu trainieren, dass sie subtile Veränderungen des Gewebes besser erkennen und auch beurteilen können. Dafür entwickelt er unter anderem Algorithmen, die bei der Einschätzung helfen sollen, ob sich aus Anomalien im Gewebe, die im MRT sichtbar werden, Brustkrebs entwickeln könnte. Damit würde eine individualisierte Risikoabschätzung möglich werden.
In einer weiteren Forschungsfrage soll geklärt werden, ob Risikofaktoren wie genetische und klinische Informationen, aber auch Sterblichkeitsdaten mit den Risikoscores aus dem MRT-Bild verknüpft werden können. Damit könnten in Zukunft die Intervalle der Vorsorgeuntersuchung an das individuelle Risikoprofil der Brustkrebspatientinnen angepasst werden.
Last but not least sollen Machine-learning Methoden soweit verbessert werden, dass Läsionen, also Veränderungen im Gewebe, besser klassifiziert und bösartige Veränderungen treffsicher als solche erkannt werden. Langs: „Damit könnten Biopsien gezielter eingesetzt werden, was wesentlich für die Lebensqualität der Betroffenen ist, aber auch das Gesundheitssystem entlastet würde.“

Glioblastome sind sehr aggressive Hirntumoren. In 85 Prozent der Glioblastomproben kann eine Mutation in der Promoterregion des Telomerase Gens (TERT) nachgewiesen werden. Durch diese Mutation binden spezielle Proteine (Transkriptionsfaktoren der ETS-Familie) an das Gen, aktivieren es und bewirken, dass das Enzym Telomerase vermehrt produziert wird. Telomerase macht Tumorzellen quasi unsterblich. Daniela Lötsch, Universitätsklinik für Neurochirurgie von MedUni Wien und AKH Wien sowie Mitglied des Comprehensive Cancer Center (CCC) der beiden Einrichtungen, untersucht im vom CCC geförderten Projekt, ob und wie diese TERT Promoter Mutation mit der sogenannten MAP-Kinase-Kaskade, einem Signalweg, der das Wachstum der Tumorzellen begünstigt, zusammenhängt. Sie sequenziert dafür das Genom der Tumorzellen und hofft damit, neue molekularbiologische Angriffspunkte für zielgerichtete Therapien zu finden.
PatientInnen mit Glioblastomen haben eine geringe Heilungswahrscheinlichkeit: Nach der Diagnose beträgt die Lebenszeit im Schnitt noch 20 Monate. Die Standardtherapie des Glioblastoms umfasst eine chirurgische Entfernung und anschließende Radio-Chemotherapie, präzisionsmedizinische Behandlungsansätze sind bis dato sehr rar. Lötsch und ihr Team beleuchten in ihrem Projekt daher die genetischen Ursachen der Erkrankung mit dem Ziel ihre Mechanismen besser zu verstehen und Angriffspunkte für zielgerichtete Therapien zu finden.
Chronologie der Mutationen
Im Zuge ihrer Entwicklung kommt es bei allen Tumoren zu genetischen Veränderungen in den Krebszellen, die spontan aber auch durch Einflüsse innerhalb oder außerhalb der Zellen passieren. Diese Mutationen verstärken zum Beispiel die Fähigkeit des Tumors, den plötzlichen Zelltod (Apoptose) zu umgehen. Die Apoptose ist ein Sicherheitsmechanismus, der bei gesunden Menschen dazu führt, dass sich fehlerhafte Zellen von selber töten.
Während der Entstehung des Glioblastoms kommt es meist sehr früh zu einer Veränderung im Chromosom 7, einer speziellen Region im Erbmaterial auf dem der EGF-Rezeptor (EGFR) sitzt. Der EGFR ist ein Protein, das unter anderem den MAP-Kinase-Signalweg aktiviert. Im Glioblastom ist der EGFR übermäßig ausgebildet und führt über den MAP-Kinase-Signalweg dazu, dass der Krebs besonders aggressiv ist.
Lötsch-Gojo und ihr Team haben in Voranalysen herausgefunden, dass Medikamente, die ETS Faktoren hemmen, auch dazu führen, dass nicht nur die MAP-Kinase-Kaskade und damit das Tumorwachstum gebremst, sondern auch die Aktivität der Telomerase reduziert wird. Detaillierte Sequenzierungsanalysen haben gezeigt, dass zuerst Veränderungen am Chromosom 7 und erst später im TERT-Promotor entstehen. Lötsch-Gojo: „Wir möchten in diesem Projekt klären, ob die vermehrte Ausbildung von EGFR und damit die verstärkte Aktivierung der MAP-Kinase-Kaskade verantwortlich dafür ist, dass es zu den Mutationen im TERT-Promotor kommt und dieses Wissen für die Entwicklung zielgerichteter Therapien nützen.“
Neue Ansätze
Um diese Frage zu klären, führen die ForscherInnen Einzelzellsequenzierungen des Tumorgenoms (DNA) und parallel dazu auch Sequenzierungen des Transkriptoms durch. Das Transkriptom ist die Summe aller von der DNA in RNA umgeschriebenen und somit in der Tumorzelle aktivierten Gene. Damit prüft Lötsch-Gojo, welche Unterschiede die Sequenzierungsmuster (DNA und RNA) der TERT Promoter mutierten Glioblastomzellen im Vergleich zu Zellen mit nicht verändertem TERT Promoter (Wildtyp) aufweisen.

Der metastasierte Darmkrebs gilt als schwer behandelbar, weil es wenige Therapieoptionen gibt und es häufig zu Therapieresistenzen kommt. Veronica Moreno-Viedma, Zentrum für Krebsforschung der MedUni und Mitglied des Comprehensive Cancer Center (CCC) Vienna von MedUni Wien und AKH Wien, erforscht im vom CCC geförderten Forschungsprojekt, wie sich die Tumorzellen und die Zellen ihrer unmittelbaren Umgebung (Tumor-Mikroumgebung) gegenseitig beeinflussen und wie die eingesetzten Therapien die Funktionen der benachbarten Zellen verändern. Ziel ist es einerseits, herauszufinden, warum das metastasierte Kolonkarzinom gegen die EGFR-Therapie resistent ist und andererseits, neue Biomarker für das Therapieansprechen von PatientInnen zu finden.
Das Onkogen KRAS spielt wie in vielen Krebsarten auch beim Darmkrebs eine entscheidende Rolle bei der Krebsentstehung. Während Krebserkrankungen der Lunge und des Pankreas, die KRAS-Mutationen aufweisen, gut auf Therapien gegen den EGF-Wachstumsrezeptor ansprechen, kommt es bei der Darmkrebsbehandlung häufig zu Resistenzen. Im ersten Teil der aktuellen Arbeit untersucht Moreno-Viedma nun, warum es dazu kommt. Eine Klärung dieser Ursachen könnte zur Entwicklung neuer Therapieoptionen beitragen.
Bessere Prognose durch Stratifizierung
Im zweiten Teil des Projekts versucht sie zu ermitteln, ob eine spezielle Zusammensetzung von Immunzellen dazu beitragen könnte, dass sich Therapieresistenzen ausbilden. Dazu untersucht sie eine Gruppe von Betroffenen, die rund 25 bis 30 Prozent aller DarmkrebspatientInnen ausmacht. Bei ihnen ist KRAS nicht mutiert, es liegt also der sogenannte KRAS Wildtyp vor, was bedeutet, dass andere Mutationen bei ihnen das Tumorgeschehen befeuern. Moreno-Viedma vergleicht sie mit PatientInnen, bei denen eine KRAS-Mutation bestätigt ist. Durch den Vergleich hofft sie klären zu können, ob Unterschiede in der Interaktion der Tumorzellen mit ihrer jeweiligen Mikroumgebung zu finden sind und ob eine spezifische Zusammensetzung der Immunzellen verantwortlich für die Resistenzentwicklung ist.
In ihrer Arbeit sequenziert die Forscherin die RNA der beteiligten Zellen und erstellt deren molekulare Signatur.
Diese Genanalyse soll die Einteilung der PatientInnen in Subtypen (Stratifizierung) und damit eine personalisierte Therapiewahl ermöglichen. Moreno-Viedma hofft auch durch diese Arbeit neue Biomarker zu identifizieren, die die Vorhersage auf das Therapieansprechen verbessern können.
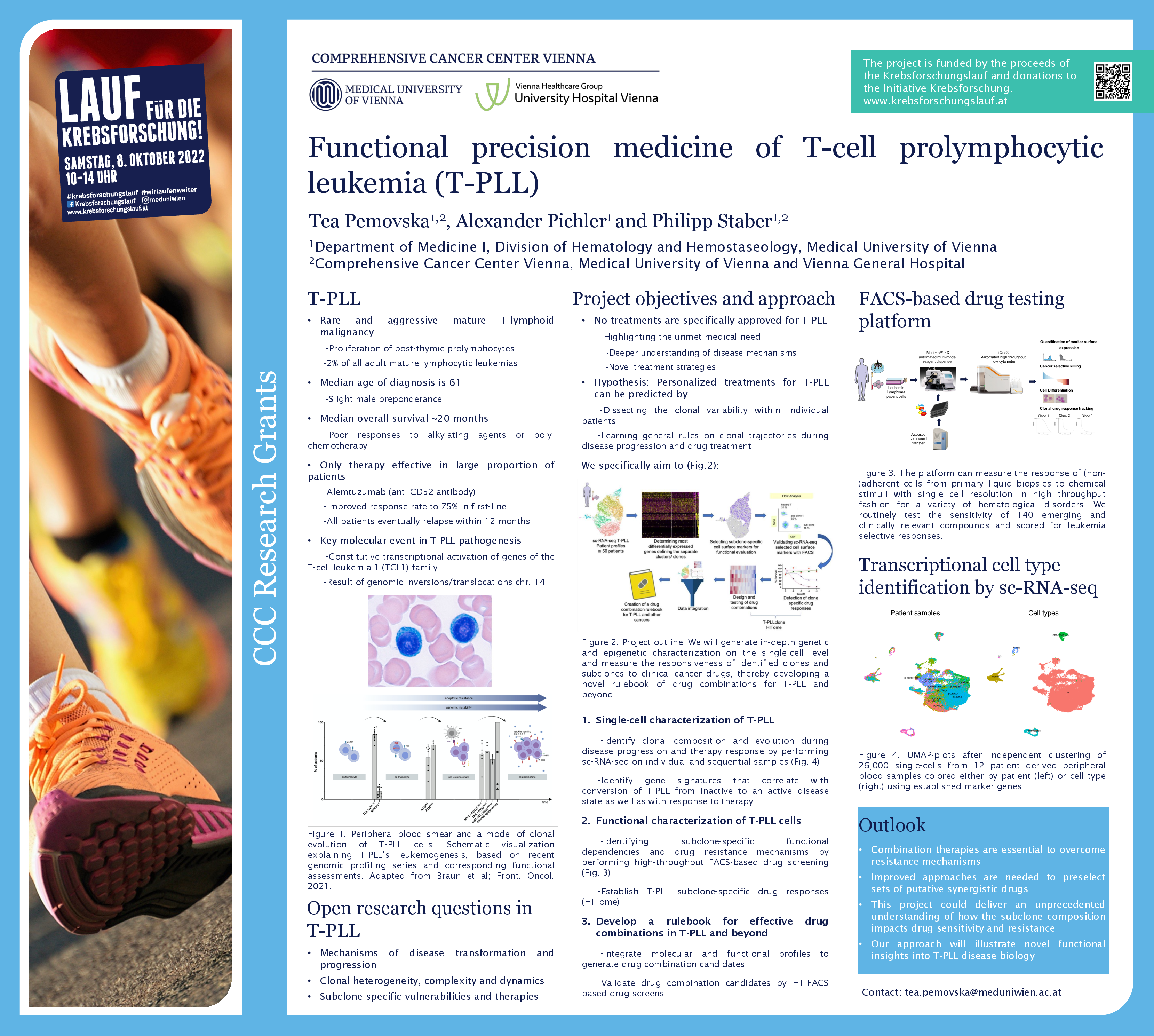
T-PLL ist eine seltene Form der Leukämie, die besonders behandlungsresistent ist. Sie zeichnet sich durch eine hohe Heterogenität aus: Das heißt, neben den Tumorzellen und deren Klone sind noch eine Reihe anderer Zellen, zum Beispiel B-Zellen und Monozyten, im Spiel. Tea Pemovska, Molekularbiologin an der Universitätsklinik für Innere Medizin I und Mitglied des Comprehensive Cancer Center (CCC) von MedUni Wien und AKH Wien, erforscht in ihrem Projekt, das mit der CCC Forschungsförderung unterstützt wird, wie die zelluläre Zusammensetzung des Tumors aussieht, welche Rolle die Klone der einzelnen Zelltypen spielen und wie sie das Tumorgeschehen beeinflussen. Das Wissen darüber könnte nicht nur das Fortschreiten der Erkrankung erklären, sondern auch warum Betroffene nur schlecht auf bestehende Therapiemöglichkeiten ansprechen. Das Ziel ist, wissenschaftliche Grundlagen für spezifischere und daher effektivere Therapiekombinationen zu entwickeln.
Die meisten Betroffenen von T-PLL überleben nach der Diagnose meist nicht länger als 20 Monate. Zurzeit gibt es keine speziell für diese Erkrankung zugelassenen Therapie. Chemotherapien wirken meist nicht, einzig ein monoklonaler Antikörper, CD52, wirkt kurzzeitig, geht aber mit beträchtlichen Nebenwirkungen einher und verliert seine Wirkung bereits nach 12 Monaten.
Erst kürzlich wurden zwei Krankheitszustände entdeckt: die inaktive, nur langsam voranschreitende und die aktive, aggressive T-PLL. Interessant ist, dass sich die inaktive T-PLL meist nach einem bis zwei Jahren in die aktive Form umwandelt, wobei die Biologie dahinter unbekannt ist. Darüber hinaus gibt es auch keine Information über die klonale Heterogenität des Tumors, also darüber aus welchen unterschiedlichen Zellklonen der Tumor besteht.
Zelldiversität verleiht Widerstandskraft
Pemovska sequenziert im Projekt die RNA der unterschiedlichen Zellen im Tumor, um zu klären, welche Gene in den Zellklonen aktiv sind, ob bestimmte Expressionsmuster zu finden sind und welche Wirkstoffe in der Lage sind, bestimmte Klone zu eliminieren.
Der Hintergrund: Heterogene Tumoren bestehen aus vielen unterschiedlichen Zelltypen und -klonen. Das macht sie widerstandsfähig gegen Einzeltherapien, denn unterschiedliche Klone in einem Tumor können verschieden auf Einzeltherapien ansprechen und andere Zelltypen dieses Ansprechen beeinflussen. Wenn aus einer Vielzahl von unterschiedlichen Tumorklonen nur eine Art ausgeschaltet wird, bleiben die anderen dennoch am Leben. Deshalb versucht man mit einer Kombination verschiedener Therapeutika gegen sie vorzugehen. Die Schwierigkeit dabei ist die Ermittlung der richtigen Kombination.
Pemovska: „Wir versuchen die Klone und Subklone der Zellen im Tumorgeschehen zu analysieren, zu prüfen, wie sie sich gegenseitig beeinflussen und auf welche Substanzen sie sensibel reagieren. Das gibt uns die Möglichkeit fundiert abzuschätzen, welche Kombinationen wirksam und effektiv sind. Unser Ziel ist es, Präzisionsmedizin für die spezifische Kombination von Arzneimitteln bei T-PLL anwendbar zu machen.“
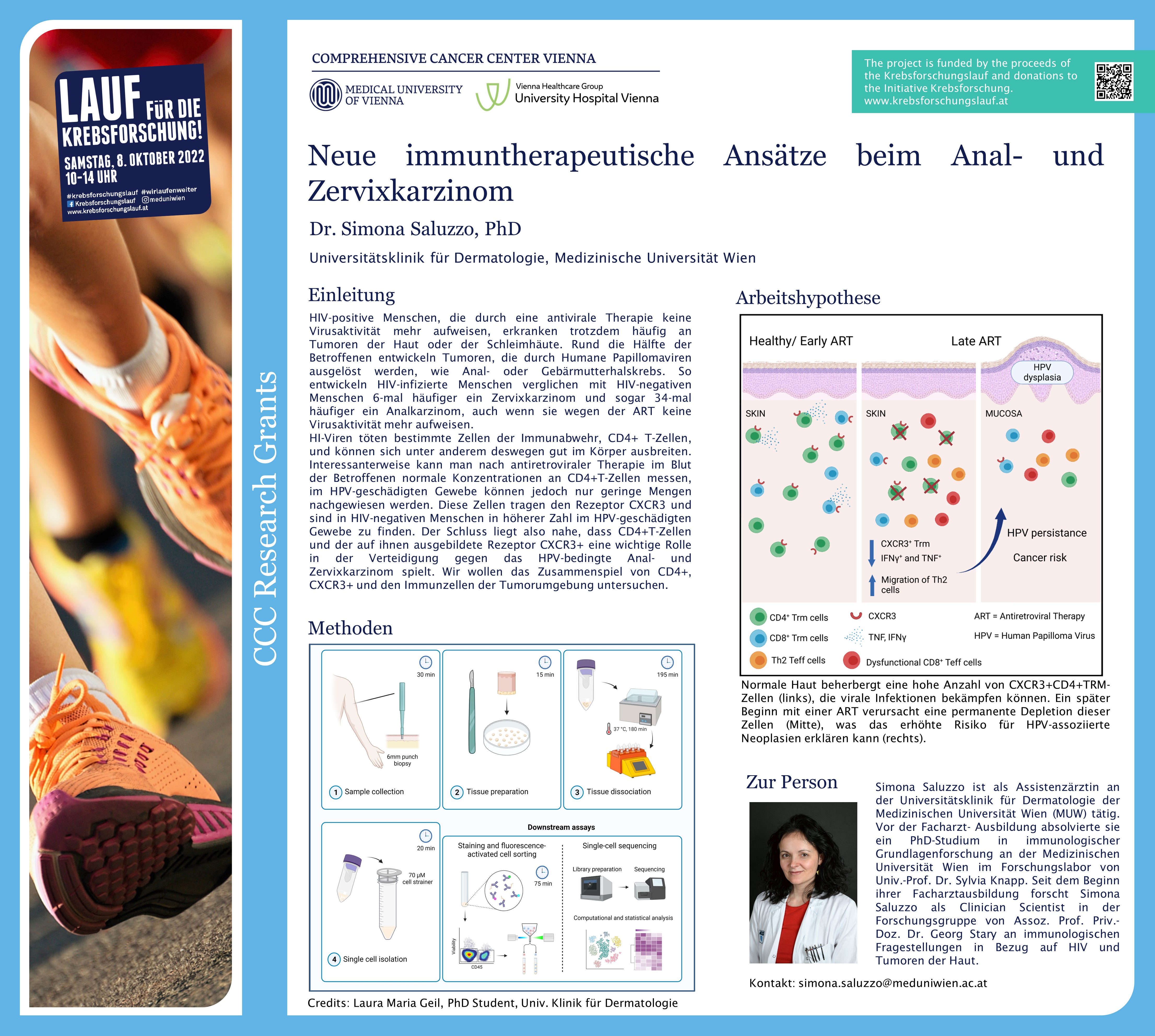
HIV-positive Menschen, die durch eine antivirale Therapie (ART) keine Virusaktivität mehr aufweisen, erkranken trotzdem häufig an Tumoren der Haut oder der Schleimhäute. Rund die Hälfte der Betroffenen entwickeln Tumoren, die durch Humane Papillomaviren ausgelöst werden, wie Anal- oder Gebärmutterhalskrebs. Simona Saluzzo, Universitätsklinik für Dermatologie und Mitglied des Comprehensive Cancer Center (CCC) von MedUni Wien und AKH Wien, erforscht in ihrer vom CCC geförderten Arbeit die Mechanismen, die dahinterstehen. Ihr Ziel ist es, neue immuntherapeutische Ansätze gegen das Analkarzinom und den Gebärmutterhalskrebs (Zervixkarzinom) zu entwickeln.
HI-Viren töten bestimmte Zellen der Immunabwehr, CD4+ T-Zellen, und können sich unter anderem deswegen gut im Körper ausbreiten. Mit der antiretroviralen Therapie (ART) bei HIV-infizierten PatientInnen kann die Vermehrung der Viren gehemmt und die Viruslast so weit gesenkt werden, dass HIV nicht mehr im Blut nachweisbar ist. Dadurch kommt es wieder zu einem Anstieg der CD4+T-Zellen im Blut und das Infektionsrisiko nimmt entsprechend ab.
Trotzdem beobachten ExpertInnen, dass diese PatientInnen vermehrt an HPV bedingten Tumoren erkranken. So entwickeln HIV-infizierte Menschen verglichen mit HIV-negativen Menschen sechsmal häufiger ein Zervixkarzinom und sogar 34-mal häufiger ein Analkarzinom, auch wenn sie wegen der ART keine Virusaktivität mehr aufweisen.
Interessanterweise kann man nach antiretroviraler Therapie im Blut der Betroffenen normale Konzentrationen an CD4+T-Zellen messen, im HPV-geschädigten Gewebe können jedoch nur geringe Mengen nachgewiesen werden. Diese Zellen tragen den Rezeptor CXCR3 und sind in HIV-negativen Menschen in höherer Zahl im HPV-geschädigten Gewebe zu finden. Der Schluss liegt also nahe, dass CD4+T-Zellen und der auf ihnen ausgebildete Rezeptor CXCR3+ eine wichtige Rolle in der Verteidigung gegen das HPV-bedingte Anal- und Zervixkarzinom spielt.
Neue immuntherapeutische Ansätze
Saluzzo: „Wir wollen nun klären, welche Verbindung es genau zwischen dem Verlust der CD4+T-Zellen im Gewebe, dem Vorkommen und dem Verbleib von HPV in diesen Arealen sowie der Entwicklung von Krebs besteht. Wenn es uns gelingt, die Mechanismen, die dahinterstehen, zu klären, könnte dies zu neuen Therapieansätzen beim Anal- und Zervixkarzinom aber auch bei anderen HPV-induzierten Krebserkrankungen führen.“
Saluzzo wird in ihrer Arbeit das Zusammenspiel von CD4+, CXCR3+ und den Immunzellen der Tumorumgebung untersuchen und dafür single-cell RNA-Sequenzierungen durchführen.

Entwickeln Brustkrebspatientinnen, die an einer Mutation des BRCA1-Gens leiden, vermehrt Hirnmetastasen? Welche anderen Gene könnten an diesem Geschehen noch beteiligt sein und wäre dann ein neuer Therapieansatz sinnvoll und erfolgreich? Diesen Fragen geht Yen Tan, Krebs-Epidemiologin an der Universitätsklinik für Frauenheilkunde und Mitglied des Comprehensive Cancer Center (CCC) von MedUni Wien und AKH Wien, in ihrem Projekt, das mit der CCC Forschungsförderung unterstützt wird, nach. In ihrer Studie erstellt sie molekulare Genanalysen aus Blutproben der Patientinnen, um möglichen Veränderungsmustern auf die Spur zu kommen. Damit hofft sie neue Einblicke in die Signalwege zu gewinnen, die in die Entstehung von Hirnmetstasen involviert sind, und in Folge Hinweise auf Ansatzpunkte für neue Behandlungsmethoden zu erhalten.
20 bis 30 Prozent aller Patientinnen mit invasivem Brustkrebs sind mit einem Rückfall und der Entstehung von Metstasen konfrontiert. Fünf Prozent davon entwickeln Gehirnmetastasen wobei die Rate bei Patientinnen gewisser Subgruppen bis zu 40 Prozent beträgt. Das betrifft vor allem Frauen, die an HER2-positiven oder triple-negativen Brustkrebs leiden. ExpertInnen vermuten, dass diese Zahlen steigen werden, da die Patientinnen auf Grund der besseren Therapien länger leben und das metastasierte Stadium daher vermehrt erreichen werden. Neue Therapieansätze werden somit dringend benötigt.
Der Großteil der Brustkrebspatientinnen mit Hirnmetastasen wird derzeit mit lokalen Therapien (Chirurgie und Radiotherapie) und zusätzlicher Chemotherapie behandelt. Tan: „Wir wollen prüfen, ob BRCA-Mutationen bei Brustkrebspatientinnen, die Hirnmetastasen entwickelt haben, vermehrt vorkommen. Sollte sich das bewahrheiten, könnten sie von einer Behandlung mit PARP-Inhibitoren profitieren.“
PARP-Inhibitoren sind eine Gruppe von Arzneistoffen, die die Reparatur von DNA-Schäden in Krebszellen unterbinden, was letztlich zu ihrem Tod führt. PARP-Inhibitoren werden meist in Verbindung mit Chemotherapien angewendet und gelten heute als Standardtherapie bei Krebsarten, die durch BRCA-Mutationen entstehen.
Sollten andere genetische Mutationen an der Metastasierung beteiligt sein, könnten sich auch hier neue, personalisierte Behandlungsansätze ableiten lassen.